Conceptos:
• Solución: Dispersión homogénea de dos o más sustancias. La proporción entre ellas define cual es el solvente y cuál es el soluto.
- Solvente: Sustancia que se encuentra en mayor proporción. Solo hay un único solvente en una solución.
- Soluto: Sustancia que se encuentra en menor proporción. Pueden haber más de un soluto en una solución.
Soluciones
Una solución poder ser:
1. Diluida: Cuando la masa de soluto disuelta es pequeña en relación con la de solvente.
2. Concentrada: Cuando la masa de soluto es mayor, pero menor al máximo posible de disolución.
3. Saturada: Cuando la masa de soluto es superior al máximo posible de disolución en un solvente, a determinada temperatura (es decir, que el solvente contiene el máximo de soluto que se puede disolver en el mismo).
“En los seres vivos el mayor componente es el agua, el cual actúa como solvente universal”
Solubilidad: Cantidad de soluto capaz de disolverse en un solvente a cierta temperatura y presión. Depende de la naturaleza del soluto y del solvente, y de la temperatura y presión.
Concentración
Relación entre la cantidad de soluto y la de solvente, o de solución (relación soluto – solvente o soluto – solución). Existen muchas formas diferentes para expresar las concentraciones:
• Molaridad (M).
• Molalidad (m).
• Osmolaridad (Osm).
• Fracción molar (X).

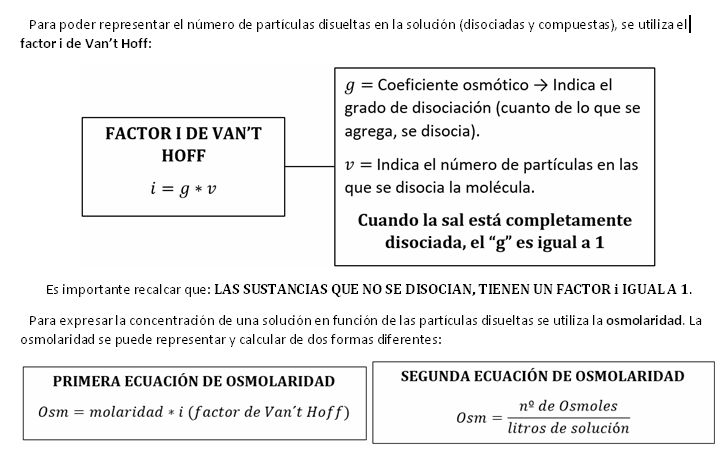
• Osmol: Cantidad de sustancias que tienen 6,02 x 1023 partículas (número de
Avogadro → 6,02 x 1023).
Como conclusión, podemos afirmar que las sustancias que se disocian, tienen
mayor osmolaridad que las que no lo hacen. Esto se debe a que, al disociarse,
aumentan la cantidad de partículas disueltas en la solución.
Osmosis
Fenómeno que describe el pasaje de solvente desde una solución más diluida a una
más concentrada, cuando ambas, se encuentran separadas por una membrana
semipermeable.
Presión Osmótica
La presión osmótica, es la presión que se debe aplicar a una solución para
impedir el pasaje de solvente hacia ella. Cada solución (la diluida y la
concentrada) debe estar separada entre sí por una membrana semipermeable pura.
La presión osmótica es una propiedad de la solución, que depende de la
osmolaridad de la misma y de la temperatura a la que se mide. Se la puede
calcular con la ecuación de Van’t Hoff:

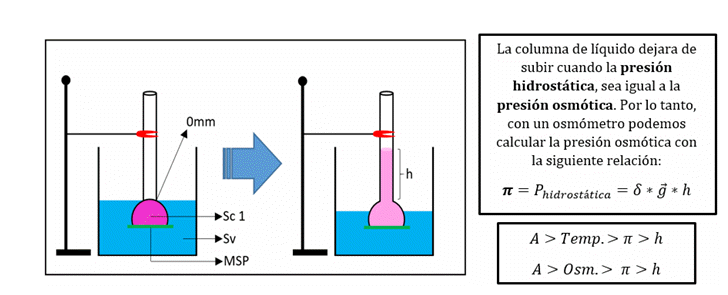
Determinación experimental de la presión osmótica
La presión osmótica se puede medir experimentalmente a través de un osmómetro. El mismo consiste en un tubo delgado (con una escala milimetrada) al que se le coloca en su base una membrana semipermeable pura. Dentro del tubo, se añade una solución hasta el 0 de la escala para luego introducirlo, al mismo nivel, en un recipiente más grande que contiene el mismo solvente (puro) de la solución que se encuentra dentro del tubo. Luego de un tiempo, parte del solvente pasará al interior del tubo por osmosis y la columna de líquido en el interior del tubo se elevara hasta una determinada altura:
Clasificación de soluciones
Podemos clasificar las soluciones según su osmolaridad respecto con la del medio
externo, en:
- Isoosmolar: Presenta la misma osmolaridad que el medio. (Isotónico)
- Hipoosmolar: Presenta menor osmolaridad que el medio. (Hipotónico)
- Hiperoosmolar: Presenta mayor osmolaridad que el medio. (Hipertónico)
Difusión
Se puede definir a la difusión, como la tendencia de una sustancia a esparcirse
en un medio. Podemos estimar la cantidad de moléculas que se difunden por una
determinada sección (superficie) en un determinado tiempo, utilizando la ley de
Fick. Su expresión matemática es
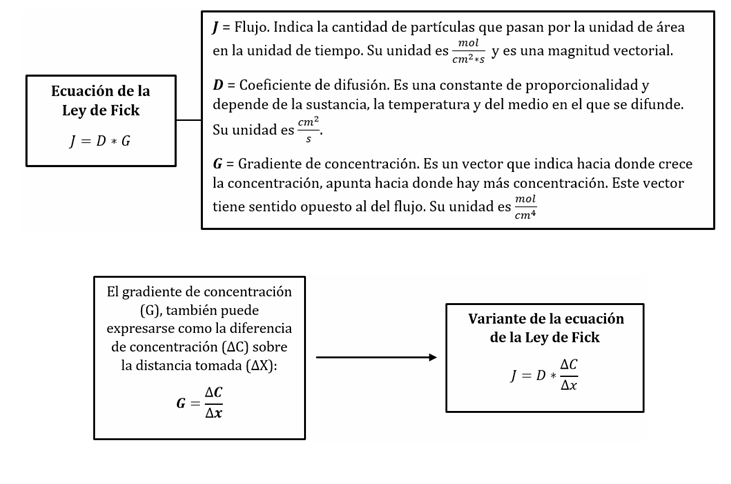
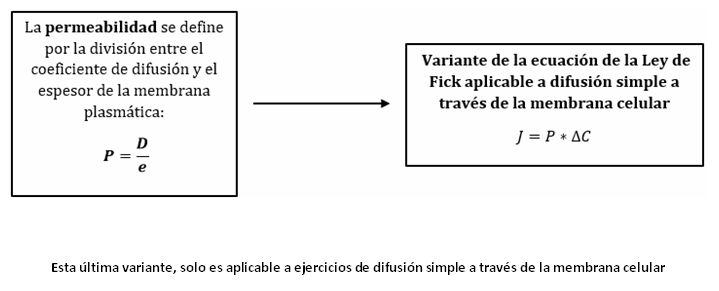
Esta ley se puede aplicar a la difusión simple, de partículas no cargadas,
a través de las membranas celulares. Debemos aplicar la variante (anteriormente
explicada) de la ecuación de la ley de Fick, solo que debemos cambiar “ ” por el
espesor constante de la membrana plasmática, representado con la letra .
Con esta modificación, se obtiene un nuevo termino que llamaremos Permeabilidad
y se calcula como la división (cociente) entre el coeficiente de difusión (D) y
el espesor (e), por lo cual, la ecuación de la ley de Fick queda: