
Altillo.com > Exámenes > UBA - Farmacia y Bioquímica > Química General e Inorgánica I
| Química General e Inorgánica | Trabajo Práctico nº5: ph y reacción acido base | 2007 | Altillo.com |
Objetivos:
1. Verificar el principio de Le Chatelier
Materiales y reactivos:
+ Tubos de ensayo
+ Espectrómetro
+ Dicromato de potasio
+ Cloruro de bario
+ Agua destilada
+ Hidróxido de sodio
+ Acido nítrico
Procedimiento:
Realizado en base a la Guía de Seminarios y Trabajos Prácticos de Química General e Inorgánica, paginas 208 y 209
Resultados:
Experimento 1:
Tubo 1 + Es el de naranja mas intenso y menor precipitado
Tubo 2 ++ Disminuye la intensidad del color y aumenta el precipitado
Tubo 3 +++ Disminuye la intensidad del color y aumenta la cantidad de precipitado
Tubo 4 ++++ Disminuye la intensidad del color y aumenta la cantidad de precipitado
Tubo 5 +++++ Es el de amarillo mas intenso y mayor precipitado
Experimento 2:
a) Desplazamiento del equilibrio cromato – dicromato por el agregado de base
|
Tubo |
Absorbancia |
|
1 2 3 4 5 6 |
1.125 1.129 0.994 0.908 0.727 0.572 |
b) Desplazamiento del equilibrio cromato – dicromato por el agregado de acido
|
Tubo |
Absorbancia |
|
1 2 3 4 5 6 |
0.021 0.171 0.326 0.484 0.601 0.849 |

Experimento 3 :
a) Utilizamos el pHmetro para averiguar los pH de las soluciones dadas.
Los resultados, si bien similares, difieren de los resultados teóricos porque el
pHmetro mide actividad. En el caso del HNO3 reacciono menos cantidad de acido,
entonces el aparato midió menos concentración de protones. Por esta razón el pH
dio mayor que el teórico.
En el caso del NaOH ocurre lo mismo, y por eso el pH que obtuvimos fue distinto
del teórico.
Con el HAc, es un acido débil y no se disocia por completo en agua, por lo tanto
para hallar el pH analítico se debe plantear el equilibrio.
Con el pHmetro, obtuvimos un valor menor al analítico ya que como dijimos antes,
solo mide la actividad. Lo mismo ocurre con el NH3
b) Al diluir el las soluciones de acido y de base observamos que el pH del acido
aumentaba con la dilución, y el pH de la base disminuía con la dilución.
Experimento 4:
Medimos el pH con la ayuda de tiras indicadoras. Los resultados obtenidos se
justifican de este modo:
Tubo 1: Agua con NaCl
pH: 7
Fue el esperado debido a que el NaCl es una sal formada por una base fuerte (NaOH)
y un acido fuerte (HCl) por lo tanto no hidroliza y su pH es neutro.
Tubo 2: Agua con Acetato de sodio
pH: 8
El Acetato de amonio es una sal formada por un acido débil (Acido acético) y una
base fuerte (NaOH), por lo tanto tiene un pH básico ya que el anion es capaz de
reaccionar con el agua y quitarle un protón.
Al quitarle un protón al agua, esta queda como anion hidroxilo, y por lo tanto
la solución es básica.
Tubo 3: Agua con NH4Cl
pH: 6
A este tubo lo calentamos para eliminar el CO2 que contenía el agua destilada y
le agregamos NH4Cl, que es una sal proveniente de un acido fuerte (HCl) y una
base débil (NH3) por lo tanto la solución es acida, ya que el catión es capaz de
cederle un protón al agua.
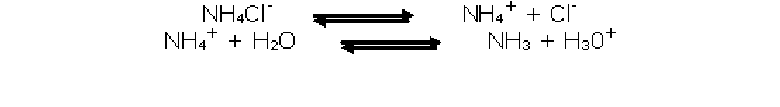
Tubo 4: Agua destilada
pH: 6
El pH fue mas alto de lo esperado ya que en el proceso de destilación se produce CO2, que al reaccionar con el agua produce H2CO3, pero como este es muy inestable, se disocia y quedan en solución acuosa bicarbonato y protones, la presencia de estos hace que baje el pH del agua destilada, por eso el pH es acido.
Experimento 5:
Mediante la titulacion del acido nítrico utilizando el hidróxido de sodio determinamos la normalidad del acido.
Sabiendo que un equivalente de base reacciona con un equivalente de acido, agregamos gota a gota el NaOH (solución valorante) con la bureta en el erlenmeyer que contenía al acido (solución a valorar).
Utilizamos un indicador (fenolftaleina) que cambia de color cuando la solución pasa de acida a básica o viceversa
En el punto en el que la solución incolora de acido se tornara rosada, ese seria el punto de equivalencia, punto en el cual el numero de equivalentes de ácido es igual al numero de equivalentes de base.
El volumen de solución valorante introducido en el erlenmeyer al llegar al punto de equivalencia fue de 9 ml, por lo tanto mediante los cálculos determinamos que la normalidad del acido nítrico era 0.0940