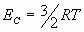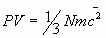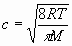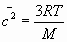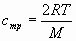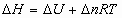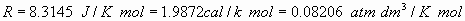Altillo.com
> Exámenes > UBA
- Ciencias Exactas > Química
|
Química |
1° Parcial |
Recuperatorio |
19 / 7 / 1999 |
Altillo.com |
1) Decidir si las siguientes afirmaciones son verdaderas o falsas, justificar
empleando el modelo de orbitales moleculares:
a) El orden de unión para la molécula de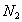 es mayor que la molécula de
es mayor que la molécula de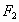 ,
pero menor que la molécula de
,
pero menor que la molécula de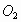 .
.
b) Para explicar algunos resultados experimentales mediante el modelo de OM es
necesario emplear el concepto de resonancia.
c) Tanto la molécula de CO como la de CO’ son diamagnéticas.
d) Los orbitales moleculares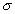 siempre
se construyen a partir de orbitales atómicos s porque tienen igual
simetría.
siempre
se construyen a partir de orbitales atómicos s porque tienen igual
simetría.
e) La longitud del enlace en la molécula de CN’ es menor que la de la
molécula de CN.
f) Los orbitales moleculares ligantes no tienen ningún nodo en el eje
internuclear.
Datos: 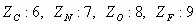 .
.
Notas: Considerar que para todas las moléculas diatómicas del problema,
puede emplearse el mismo diagrama de orbitales moleculares en el cual, según
energía creciente, el orden de los OM es: 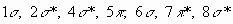 .
.
2_a) Se colocan un mol de nitrógeno en un recipiente de 10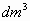 ,
y un mol de
,
y un mol de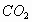 en un recipiente de 5
en un recipiente de 5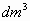 ,
ambos a 27°C. Suponiendo válida la teoría cinética de los gases, calcular
para cada gas:
,
ambos a 27°C. Suponiendo válida la teoría cinética de los gases, calcular
para cada gas:
i) La energía molecular media. ii) La velocidad media.
iii) La presión.
b) Se añade en cada recipiente 1 mol de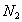 y se eleva la temperatura a 127°C en ambos. Calcular, para cada gas en cada
recipiente:
y se eleva la temperatura a 127°C en ambos. Calcular, para cada gas en cada
recipiente:
i) La energía molecular media. ii) La velocidad media.
iii) La presión
parcial.
Explique las igualdades y diferencias entre los dos gases para las propiedades
calculadas.
c) Representar en un mismo gráfico, esquemáticamente, la distribución de
velocidades esperadas para el 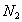 y el
y el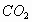 a 24°C, y en otro, para
a 24°C, y en otro, para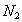 a 27 y 127°C.
a 27 y 127°C.
Datos: 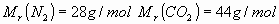
3_a) Calcular las variaciones estándar de entalpía 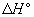 y energía interna
y energía interna 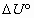 para la combustión de un mol de ácido láctico
para la combustión de un mol de ácido láctico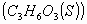 para dar
para dar 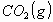 y
y 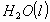 .
.
b) Se tiene una bomba calorimétrica de acero, cuya masa es de 14 kg. y tiene
una capacidad de 400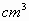 .
Esta bomba se carga con 0.62g de ácido láctico y se llena de oxígeno gaseoso
hasta una presión de 20 bar. Se coloca esta bomba en un baño de 2,5 L de agua
como indica la figura. Todo el conjunto está inicialmente a 24°C. El conjunto
es adiabático.
.
Esta bomba se carga con 0.62g de ácido láctico y se llena de oxígeno gaseoso
hasta una presión de 20 bar. Se coloca esta bomba en un baño de 2,5 L de agua
como indica la figura. Todo el conjunto está inicialmente a 24°C. El conjunto
es adiabático.
Se produce la reacción de combustión, quemándose completamente el ácido
láctico a 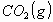 y
y 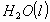 .
Calcular la temperatura final del sistema. Suponer que la capacidad calorífica
de las sustancias dentro de la bomba es despreciable frente a la del agua y la
de la bomba.
.
Calcular la temperatura final del sistema. Suponer que la capacidad calorífica
de las sustancias dentro de la bomba es despreciable frente a la del agua y la
de la bomba.
Datos:
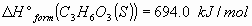
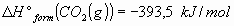
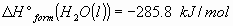
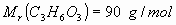
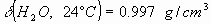
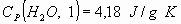
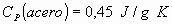
Fórmulas