Altillo.com > Exámenes > UBA - UBA XXI > Química
|
Química |
2° Parcial |
1º Cuat. de 2007 |
Altillo.com |
A) Se hacen reaccionar 100g. de una muestra de óxido ferroso (95% de pureza)con exceso de disolución acuosa 1,00M de HNO3, según la ecuación:
![]() FeO
+ 2HNO3 Fe (NO3)2
+ H2O
FeO
+ 2HNO3 Fe (NO3)2
+ H2O
1) Señalar si la ecuación representa una reacción redox. Justificar al dorso
2) Calcular el volumen de disolución usada que es necesario para reaccionar estequiometricamente con todo el FeO contenido en la muestra.
3) Si el rendimiento de la reacción es del 90%, determinar la masa de sal que se obtendrá.
4) Si se utilizaron 2,65 dm3 de disolución HNO3 0,5 M, manteniendo todas las demás condiciones, señalar si la masa de sal obtenida sería mayor, igual o menor.
B) En un recipiente rígido de 5 dm3 se colocan 187g de NH3 (Mr=17) a la temperatura T. El sistema evoluciona hasta llegar al equilibrio, representado por:
![]() 2
NH3 3 H2
+ N2
Siendo [N2] eq= 0,1M
2
NH3 3 H2
+ N2
Siendo [N2] eq= 0,1M
1) Calcular la Kc.
2) Representar gráficamente el n° de moles de NH3 en función del tiempo.
C) Se dispone de 500 ml de cada una de las siguientes disoluciones:
a) NaOH, pH 12 b)amoníaco (Kb= 1,82x10-5),pH 12 c)etilamina (Kb=4,68x10-4),pH12
d)H Cl 0,01M e) NaCl 0,01M f) C2H5NH3Cl 0,01M
1) Se diluye la solución d) hasta obtener un pH=2,5. Calcular el volumen de disolución que se obtiene.
2) Indicar si la [OH-] de la disolución a) es mayor, menor o igual que la disolución d).
3) Calcular cuántos moles de ión hidróxido hay en los 500 ml de disolución c).
4) Comparar las soluciones a),b) y c) y sin realizar cálculos, decidir cuál es la más concentrada.
5) Selecciona un par que formen una solución reguladora.
6) Determinar si la solución reguladora será adecuada para mantener el pH alrededor de 10. Justificar al dorso
7) Formular las especies iónicas presentes en la disolución f).
D) Dados los compuestos : I)butanol II)butanal III)dietileter
1) 1) Ordenarlas según el punto de ebullición decreciente.
2) 2) Escribir la fórmula estructural y dar el nombre de un isómero de cadena de II).
3) 3) Escribir la fórmula estructural de un isómero de I) que posea un C quiral, señalando el mismo. Al dorso.
4) 4) Nombrar el siguiente compuesto: CH2OH-CH(OH)-CH2-CHO
RESPUESTAS
A)
1) La ecuación NO representa una reacción redox. Esto es porque no hay transferencia de electrones entre los elementos. Es decir, tanto en los reactivos como en los productos, cada elemento trabaja con el mismo numero de oxidación (no cambia).
Este tipo de reacción se llama de sustitución o desplazamiento.
2) 2,65 dm3
3) 214,1 g
4) Menor
B)
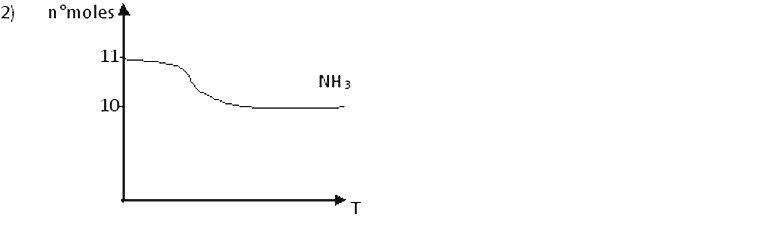
C)
1) 1,58 dm3
2) Mayor
3) 0,005 mol
4) b)
5) c) y f)
6)La solución reguladora C2H5NH2 / C2H5NH3Cl
es apta para mantener el pH alrededor de 10 dado que su pKa = 10,67 por lo que
el sistema será eficaz entre 9,67 y 11,67. Para encontrar el pKa primero
averiguamos el pKb a partir del dato de Kb = 4,68 x 10-4___________
pKb= 3,33 ; y como pKa + pKb =14 entonces pKa = 14 – 3,33 = 10,67.
7) C2H5NH3 +
Cl-
OH-
H3O +
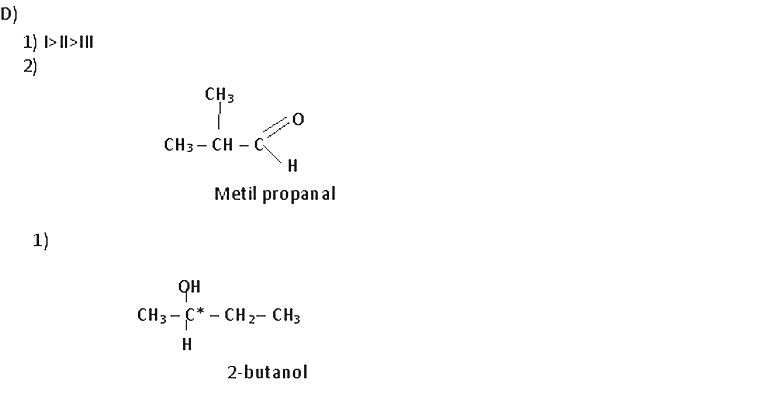
1) 2 ) 3,4- dihidroxibutanal